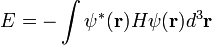The Hero
الأســــــــــــــطورة

- إنضم
- Jun 29, 2008
- المشاركات
- 20,103
- مستوى التفاعل
- 69
- المطرح
- في ضحكة عيون حبيبي
الرمز الكيميائي هو اختصار أو تمثيل أصغر لأسماء العناصر الكيمائية. جميع العناصر الطبيبعية لها رمز يتكون من حرف أو إثنين, والعناصر المؤقتة لها رمز مكون من ثلاثة أحرف .
جميع الرموز الكيميائية موجودة في الجدول الدوري وتستخدم في المعادلات الكيميائية :
2H2+O2---------->2H2O
ونظرا لأن معظم الرموز الكيميائية مشتقة من الاسم اللاتيني أو من الإغريقة, فيمكن أن لا تماثل الاسم الإنجليزي الذي تسمى به, فمثلا الصوديوم " Sodium " اسمه اللاتيني natrium والذهب " Gold " و اسمه اللاتيني aurum .
يمكن للرمز الكيميائي أن يتغير لإظهار نظير معين للعنصر, ولإظهار الخواص الأخرى مثل التأين والتأكسد للرمز الكيميائي.
جميع الرموز الكيميائية موجودة في الجدول الدوري وتستخدم في المعادلات الكيميائية :
2H2+O2---------->2H2O
ونظرا لأن معظم الرموز الكيميائية مشتقة من الاسم اللاتيني أو من الإغريقة, فيمكن أن لا تماثل الاسم الإنجليزي الذي تسمى به, فمثلا الصوديوم " Sodium " اسمه اللاتيني natrium والذهب " Gold " و اسمه اللاتيني aurum .
يمكن للرمز الكيميائي أن يتغير لإظهار نظير معين للعنصر, ولإظهار الخواص الأخرى مثل التأين والتأكسد للرمز الكيميائي.